- Հեղինակ Jason Gerald [email protected].
- Public 2024-02-01 14:13.
- Վերջին փոփոխված 2025-01-23 12:20.
Երբևէ մեկ շիշ ջուր տաք արևի տակ թողե՞լ եք մի քանի ժամ և բացելիս լսել եք թեթևակի «սուլոցի» ձայն: Դա պայմանավորված է մի սկզբունքով, որը կոչվում է գոլորշու ճնշում: Քիմիայում գոլորշու ճնշումը փակ կոնտեյների պատերի կողմից գործադրվող ճնշումն է, երբ դրանում քիմիական նյութը գոլորշիանում է (վերածվում է գազի): Տվյալ ջերմաստիճանում գոլորշու ճնշումը գտնելու համար օգտագործեք Կլաուսիուս-Կլապեյրոնի հավասարումը. ln (P1/P2) = (ΔHգոլորշի/Հ) ((1/T2) - (1/T1)).
Քայլ
Մեթոդ 1-ից 3-ը ՝ Կլաուսիուս-Կլապեյրոնի հավասարման օգտագործումը
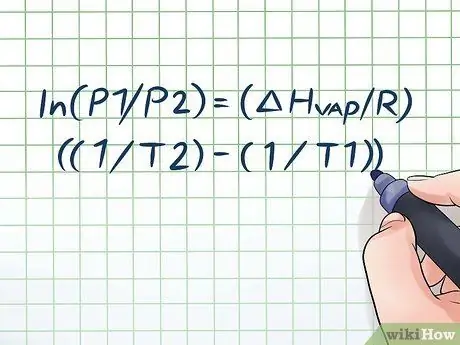
Քայլ 1. Գրեք Կլաուսիուս-Կլապեյրոնի հավասարումը:
Theամանակի ընթացքում գոլորշու ճնշման փոփոխությամբ գոլորշու ճնշումը հաշվարկելու համար օգտագործվող բանաձևը կոչվում է Կլաուսիուս -Կլապեյրոնի հավասարում (անվանվել է ֆիզիկոսներ Ռուդոլֆ Կլաուսիուսի և Բենուա Պոլ մղոն Կլապեյրոնի պատվին): Ֆիզիկայի և քիմիայի դասերին հաճախ հանդիպում են գոլորշու ճնշման վերաբերյալ հարցեր: Բանաձևն այսպիսին է. ln (P1/P2) = (ΔHգոլորշի/Հ) ((1/T2) - (1/T1)). Այս բանաձևում փոփոխականները ներկայացնում են.
-
Հգոլորշի:
Հեղուկի գոլորշիացման էնթալպիա: Սովորաբար այս էնթալպիան կարելի է գտնել քիմիայի դասագրքի հետևի մասի աղյուսակում:
-
R:
Իրական/ունիվերսալ գազի հաստատուն, կամ 8.314 J/(K × մոլ):
-
Q1:
Theերմաստիճանը, որով հայտնի է գոլորշու ճնշումը (կամ նախնական ջերմաստիճանը):
-
T2:
Theերմաստիճանը, որի դեպքում գոլորշու ճնշումը անհայտ է/ցանկացել է գտնել (կամ վերջնական ջերմաստիճանը):
-
P1 և P2:
Գոլորշու ճնշումը համապատասխանաբար T1 և T2 ջերմաստիճաններում:

Քայլ 2. Մուտքագրեք ձեր իմացած փոփոխականները:
Կլաուսիուս-Կլապեյրոնի հավասարումը բարդ տեսք ունի, քանի որ այն ունի շատ տարբեր փոփոխականներ, բայց իրականում դա այնքան էլ դժվար չէ, եթե ճիշտ տեղեկատվություն ունենաս: Գոլորշու ճնշման հիմնական հիմնախնդիրները կներկայացնեն ջերմաստիճանի երկու արժեք և ճնշման մեկ արժեք կամ ճնշման երկու արժեք և ջերմաստիճանի մեկ արժեք. Երբ պարզեք դա, այս հավասարումը լուծելը շատ հեշտ է:
- Օրինակ, ասեք, որ մեզ ասում են, որ մենք ունենք 295 K ջերմաստիճանում հեղուկով լի տարա, որի գոլորշու ճնշումը 1 մթնոլորտ է (ատմ): Մեր հարցն է. Ո՞րն է գոլորշու ճնշումը 393 K- ում: Մենք ունենք երկու ջերմաստիճանի և մեկ ճնշման արժեք, ուստի կարող ենք գտնել ճնշման մյուս արժեքները ՝ օգտագործելով Կլաուսիուս-Կլապեյրոնի հավասարումը: Միացնելով մեր փոփոխականները ՝ մենք ստանում ենք ln (1/P2) = (ΔHգոլորշի/Ռ) ((1/393) - (1/295)).
- Նկատի ունեցեք, որ Clausius-Clapeyron հավասարման համար դուք միշտ պետք է օգտագործեք ջերմաստիճանի արժեքը Քելվին. Դուք կարող եք օգտագործել ցանկացած ճնշման արժեք, քանի դեռ P1- ի և P2- ի արժեքները նույնն են:

Քայլ 3. Մուտքագրեք ձեր հաստատունները:
Կլաուսիուս-Կլապեյրոնի հավասարումը ունի երկու հաստատուն ՝ R և Hգոլորշի. R- ը միշտ հավասար է 8.314 J/(K × Mol): Այնուամենայնիվ, Հգոլորշի (գոլորշիացման էնթալպիան) կախված է այն նյութից, որի գոլորշու ճնշումը դուք փնտրում եք: Ինչպես նշվեց վերևում, դուք սովորաբար կարող եք գտնել H- ի արժեքներըգոլորշի քիմիայի կամ ֆիզիկայի դասագրքի հետևում կամ առցանց տարբեր նյութերի համար (ինչպես, օրինակ, այստեղ)
-
Մեր օրինակում, ենթադրենք, մեր հեղուկն է մաքուր ջուր:
Եթե աղյուսակում նայենք H- ի արժեքներըգոլորշի, գտնում ենք, որ Հգոլորշի մաքուր ջուրը կազմում է մոտ 40,65 Կ K/մոլ: Քանի որ մեր H արժեքը ջոուլների մեջ է, և ոչ թե կիլոջոուլների, մենք կարող ենք այն վերածել 40,650//մոլ:
- Միացնելով մեր հաստատունները ՝ մենք ստանում ենք ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295)).
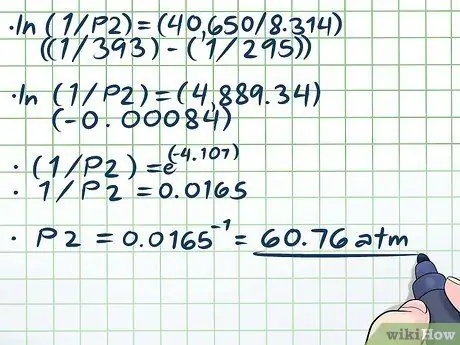
Քայլ 4. Լուծիր հավասարումը:
Հաշվի մեջ ներառելով բոլոր փոփոխականները, բացի ձեր փնտրածից, անցեք հավասարման լուծմանը սովորական հանրահաշվի կանոնների համաձայն:
-
Մեր հավասարումը լուծելու միակ դժվար մասը (ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295))) լուծում է բնական տեղեկամատյանը (ln): Բնական գրանցամատյանը հեռացնելու համար պարզապես օգտագործեք հավասարման երկու կողմերն էլ որպես մաթեմատիկական e հաստատունի ցուցիչներ: Այլ կերպ ասած, ln (x) = 2 → եln (x) = ե2 → x = e2.
- Հիմա եկեք լուծենք մեր հավասարումը.
- ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295))
- ln (1/P2) = (4889, 34) (-0, 00084)
- (1/P2) = էլ(-4, 107)
- 1/P2 = 0.0165
-
P2 = 0.0165-1 = 60, 76 ատմ.
Սա իմաստ ունի. Փակ տարայում ջերմաստիճանը գրեթե 100 աստիճանի բարձրացնելը (եռման կետից գրեթե 20 աստիճան բարձր) շատ գոլորշի կարտադրի ՝ արագորեն բարձրացնելով ճնշումը:
Մեթոդ 2 3 -ից. Գոլորշի ճնշում գտնել լուծված լուծույթով
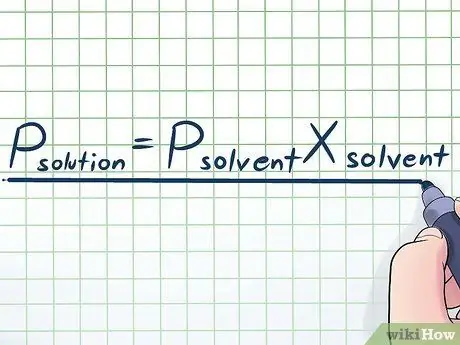
Քայլ 1. Գրեք Ռաուլտի օրենքը:
Իրական կյանքում մենք հազվադեպ ենք աշխատում մաքուր հեղուկով. Սովորաբար մենք աշխատում ենք հեղուկի հետ, որը մի քանի տարբեր նյութերի խառնուրդ է: Առավել հաճախ օգտագործվող խառնուրդներից մի քանիսը պատրաստվում են լուծույթի պատրաստման համար լուծվող լուծույթ կոչվող որոշ քիմիական նյութի մի փոքր քանակությամբ լուծույթ լուծելով: Այս դեպքերում օգտակար է իմանալ Ռաուլտի օրենք կոչվող հավասարումը (ֆիզիկոս Ֆրանսուա-Մարի Ռաուլտի անունով), որը գրված է այսպես. Պլուծված= ՊվճարունակXվճարունակ. Այս բանաձևում փոփոխականները ներկայացնում են.
-
Պլուծված:
Ամբողջ լուծույթի գոլորշու ճնշում (բոլոր տարրերը միասին)
-
Պվճարունակ:
Լուծող գոլորշու ճնշում
-
Xվճարունակ:
Լուծիչի մոլ բաժինը
- Մի անհանգստացեք, եթե չգիտեք տերմիններ, ինչպիսիք են խլուրդի մասնիկը, մենք դրանք կբացատրենք հաջորդ մի քանի քայլերում:

Քայլ 2. Որոշեք ձեր լուծույթի լուծիչն ու լուծվածը:
Նախքան խառը հեղուկի գոլորշու ճնշումը հաշվարկելը, դուք պետք է որոշեք այն նյութերը, որոնք օգտագործում եք: Որպես հիշեցում, լուծումը ձևավորվում է, երբ լուծված նյութը լուծվում է լուծիչում. Քիմիական նյութը, որը լուծվում է, միշտ կոչվում է լուծվող նյութ, իսկ քիմիական նյութը, որը ստիպում է այն լուծարվել, միշտ կոչվում է լուծիչ:
- Եկեք աշխատենք ՝ օգտագործելով այս բաժնի պարզ օրինակները ՝ մեր քննարկած հասկացությունները լուսաբանելու համար: Մեր օրինակի համար ասենք, որ մենք ցանկանում ենք գտնել շաքարի օշարակի գոլորշու ճնշումը: Ավանդաբար, շաքարի օշարակը ջրի լուծելի շաքար է (1: 1 հարաբերակցությամբ), ուստի կարող ենք դա ասել շաքարը մեր լուծված նյութն է, իսկ ջուրը `մեր լուծիչը:
- Նշենք, որ սախարոզայի (սեղանի շաքար) քիմիական բանաձևը C է12Հ22Օ11. Այս քիմիական բանաձևը շատ կարևոր կլինի:
Քայլ 3. Գտեք լուծույթի ջերմաստիճանը:
Ինչպես տեսանք վերևում գտնվող Clausius Clapeyron բաժնում, հեղուկի ջերմաստիճանը կազդի նրա գոլորշու ճնշման վրա: Ընդհանրապես, որքան բարձր է ջերմաստիճանը, այնքան մեծ է գոլորշու ճնշումը. Քանի որ ջերմաստիճանը բարձրանում է, ավելի շատ հեղուկ գոլորշիանալու է և գոլորշի է ձևավորվում ՝ մեծացնելով ճնշումը տարայի մեջ:
Մեր օրինակում, ասենք, այս պահին շաքարի օշարակի ջերմաստիճանն է 298 Կ (մոտ 25 C):
Քայլ 4. Գտեք լուծիչի գոլորշու ճնշումը:
Քիմիական տեղեկատու նյութերը սովորաբար ունեն գոլորշու ճնշման արժեքներ շատ հաճախ օգտագործվող նյութերի և միացությունների համար, սակայն ճնշման այդ արժեքները սովորաբար վավեր են միայն այն դեպքում, երբ նյութն ունի 25 C/298 K ջերմաստիճան կամ դրա եռման կետ: Եթե ձեր լուծույթն ունի այս ջերմաստիճաններից մեկը, կարող եք օգտագործել հղման արժեք, բայց եթե ոչ, ապա ձեզ հարկավոր է գտնել այդ ջերմաստիճանի գոլորշու ճնշումը:
- Clausius -Clapeyron- ը կարող է օգնել. Օգտագործել համապատասխանաբար գոլորշու ճնշում և 298 K (25 C) համապատասխանաբար P1- ի և T1- ի համար:
- Մեր օրինակում մեր խառնուրդի ջերմաստիճանը 25 C է, այնպես որ մենք կարող ենք հեշտությամբ օգտագործել մեր հեշտ տեղեկատու աղյուսակը: Մենք գիտենք, որ 25 C ջերմաստիճանում ջուրն ունի գոլորշու ճնշում 23,8 մմ HG

Քայլ 5. Գտեք ձեր լուծիչի մոլի բաժինը:
Վերջին բանը, որ մենք պետք է անենք, նախքան դա լուծելը, դա մեր լուծիչի մոլի մասնաբաժինը գտնելն է: Մոլի բաժինը գտնելը հեշտ է. Պարզապես փոխակերպեք ձեր միացությունները մոլի, այնուհետև գտեք յուրաքանչյուր միացության տոկոսը նյութի մոլերի ընդհանուր թվի մեջ: Այլ կերպ ասած, յուրաքանչյուր միացության մոլի բաժինը հավասար է (բարդության մոլ)/(նյութի մեջ մոլերի ընդհանուր քանակը):
-
Ենթադրենք, շաքարի օշարակի օգտագործման մեր բաղադրատոմսը 1 լիտր (L) ջուր և 1 լիտր սախարոզա (շաքար):
Այս դեպքում մենք պետք է գտնենք յուրաքանչյուր միացության մոլի քանակը: Դա անելու համար մենք կգտնենք յուրաքանչյուր միացության զանգվածը, այնուհետև նյութի մոլային զանգվածը կօգտագործենք այն խլերի վերածելու համար:
- Massանգված (1 լ ջուր) ՝ 1000 գրամ (գ)
- Massանգված (1 լ հում շաքար) ՝ մոտ 1,056, 8 գ
- Խալեր (ջուր) ՝ 1000 գրամ × 1 մոլ/18.015 գ = 55.51 մոլ
- Խալեր (սախարոզա) ՝ 1,056, 7 գրամ × 1 մոլ/342,2965 գ = 3,08 մոլ (նշեք, որ սախարոզայի մոլային զանգվածը կարող եք գտնել նրա քիմիական բանաձևից ՝ C12Հ22Օ11.)
- Ընդհանուր մոլեր `55.51 + 3.08 = 58.59 մոլ
- Mրի մոլ բաժինը `55, 51/58, 59 = 0, 947
Քայլ 6. Ավարտեք:
Ի վերջո, մենք ունենք այն ամենը, ինչ մեզ անհրաժեշտ է մեր Ռաուլտի օրենքի հավասարումը լուծելու համար: Այս մասը շատ հեշտ է. Պարզապես միացրեք ձեր արժեքները փոփոխությունների համար ՝ պարզեցված Raoult's Law հավասարման մեջ, այս բաժնի սկզբում (Պլուծված = ՊվճարունակXվճարունակ).
- Մտնելով մեր արժեքները ՝ մենք ստանում ենք.
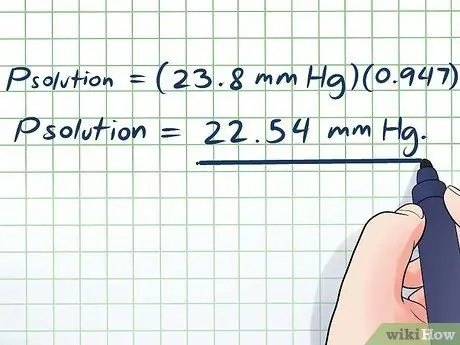
- Պլուծում = (23.8 մմ Hg) (0, 947)
-
Պլուծում = 22.54 մմ ս.ս.
Արդյունքը տրամաբանական է. Խլուրդի առումով շատ քիչ շաքար է լուծարվում շատ ջրի մեջ (չնայած իրական առումով, երկու բաղադրիչներն էլ ունեն նույն ծավալը), ուստի գոլորշու ճնշումը միայն փոքր -ինչ կնվազի:
Մեթոդ 3 -ից 3 -ը. Հատուկ դեպքերում գոլորշու ճնշում գտնելը

Քայլ 1. carefulգույշ եղեք ստանդարտ ջերմաստիճանի և ճնշման պայմանների դեպքում:
Գիտնականները հաճախ օգտագործում են ջերմաստիճանի և ճնշման արժեքների մի շարք ՝ որպես հեշտ օգտագործման «ստանդարտ»: Այս արժեքները կոչվում են Ստանդարտ ջերմաստիճան և ճնշում (կամ STP): Գոլորշու ճնշման խնդիրները հաճախ վերաբերում են STP պայմաններին, ուստի կարևոր է հիշել այդ արժեքները: STP արժեքները սահմանվում են հետևյալ կերպ.
- Երմաստիճանը: 273, 15 Կ / 0 C / 32 Ֆ
- Նշում: 760 մմ Hg / 1 ատմ / 101, 325 կիլոպասկալ

Քայլ 2. Վերադասավորեք Կլաուսիուս-Կլապեյրոնի հավասարումը `մյուս փոփոխականները գտնելու համար:
Մաս 1 -ի մեր օրինակում մենք տեսանք, որ Կլաուսիուս -Կլապեյրոնի հավասարումը շատ օգտակար է մաքուր նյութերի գոլորշու ճնշումը գտնելու համար: Այնուամենայնիվ, ոչ բոլոր հարցերը կպահանջեն ձեզ փնտրել P1 կամ P2. Շատերը ձեզ կխնդրեն գտնել ջերմաստիճանի արժեքը կամ երբեմն նույնիսկ H արժեքը:գոլորշի. Բարեբախտաբար, այս դեպքերում պատասխանը ճիշտ ստանալը պարզապես հավասարումը վերադասավորելու խնդիր է, որպեսզի այն փոփոխականները, որոնք ցանկանում ես լուծել, առանձին լինել հավասարության նշանի մի կողմում:
- Օրինակ, ասենք, որ մենք ունենք անհայտ հեղուկ ՝ 25 torr գոլորշու ճնշմամբ 273 K- ում և 150 torr 325 K- ում, և ցանկանում ենք գտնել այս հեղուկի գոլորշիացման էնթալպիան (ΔHգոլորշի): Մենք կարող ենք այն լուծել այսպես.
- ln (P1/P2) = (ΔHգոլորշի/Հ) ((1/T2) - (1/T1))
- (ln (P1/P2))/((1/T2) - (1/T1)) = (ΔHգոլորշի/Ռ)
- R × (ln (P1/P2))/((1/T2) - (1/T1)) = Hգոլորշի Այժմ մենք մուտքագրում ենք մեր արժեքները.
- 8, 314 J/(K × Mol) (-1, 79)/(-0, 00059) = Hգոլորշի
- 8, 314 J/(K × Mol) × 3,033, 90 = Hգոլորշի = 25,223, 83//մոլ

Քայլ 3. Հաշվիր լուծված նյութի գոլորշու ճնշումը, երբ նյութը գոլորշի է արտադրում:
Մեր վերը նշված Raoult Օրենքի օրինակում, մեր լուծված նյութը ՝ շաքարը, ինքնաբերաբար որևէ ճնշում չի գործադրում նորմալ ջերմաստիճանի պայմաններում (մտածեք. Վերջին անգամ ե՞րբ եք տեսել, որ շաքարավազը գոլորշիացել է ձեր վերին պահարանում): Այնուամենայնիվ, երբ ձեր լուծված նյութը գոլորշիանալ, դա կազդի ձեր գոլորշու ճնշման վրա: Մենք դա հաշվարկում ենք ՝ օգտագործելով Ռաուլտի օրենքի հավասարման փոփոխված տարբերակը. Պլուծում = (ՊբարդXբարդ) Սիգմա (Σ) խորհրդանիշը նշանակում է, որ մեր պատասխանը ստանալու համար մեզ անհրաժեշտ է ընդամենը միացնել տարբեր միացությունների գոլորշու ճնշումները:
- Օրինակ ՝ ասենք, որ մենք ունենք լուծույթ ՝ պատրաստված երկու քիմիական նյութերից ՝ բենզոլից և տոլուոլից: Լուծման ընդհանուր ծավալը 12 միլիլիտր է (մլ); 60 մլ բենզոլ և 60 մլ տոլուոլ: Լուծույթի ջերմաստիճանը 25 ° C է, և այդ քիմիական նյութերից յուրաքանչյուրի գոլորշու ճնշումը 25 ° C- ում `բենզոլի համար 95.1 մմ Hg և տոլուենի համար` 28.4 մմ Hg: Այս արժեքներով գտեք լուծույթի գոլորշու ճնշումը: Մենք կարող ենք դա անել հետևյալ կերպ ՝ օգտագործելով ստանդարտ խտության, մոլային զանգվածի և գոլորշու ճնշման արժեքները մեր երկու քիմիական նյութերի համար.
- Massանգված (բենզոլ) `60 մլ = 0.060 լ և անգամ 876.50 կգ/1.000 լ = 0.053 կգ = 53 գ
- Massանգված (տոլուոլ) `0,060 լ & անգամ 866, 90 կգ/1000 լ = 0,052 կգ = 52 գ
- Մոլ (բենզոլ) `53 գ × 1 մոլ/78, 11 գ = 0.679 մոլ
- Խալեր (տոլուոլ) `52 գ × 1 մոլ/92, 14 գ = 0.564 մոլ
- Ընդհանուր մոլեր `0.679 + 0.564 = 1.243
- Մոլի բաժին (բենզոլ) `0.679/1, 243 = 0.546
- Մոլի բաժին (տոլուոլ) `0.564/1, 243 = 0.454
- Լուծում ՝ Պլուծում = ՊբենզոլXբենզոլ + ՊտոլուոլXտոլուոլ
- Պլուծում = (95.1 մմ Hg) (0, 546) + (28.4 մմ Hg) (0, 454)
- Պլուծում = 51.92 մմ Hg + 12.89 մմ Hg = 64, 81 մմ ս.ս
Խորհուրդներ
- Վերը նշված Կլաուսիուս Կլապեյրոնի հավասարումը օգտագործելու համար ջերմաստիճանը պետք է չափել Կելվինում (գրված է որպես K): Եթե ունեք ջերմաստիճանը Celsius- ում, ապա այն պետք է փոխարկեք ՝ օգտագործելով հետևյալ բանաձևը. Տկ = 273 + Տգ
- Վերոնշյալ մեթոդները կարող են օգտագործվել, քանի որ էներգիան ճշգրիտ համաչափ է կիրառվող ջերմության քանակին: Հեղուկի ջերմաստիճանը միակ շրջակա միջավայրի գործոնն է, որն ազդում է գոլորշու ճնշման վրա:






